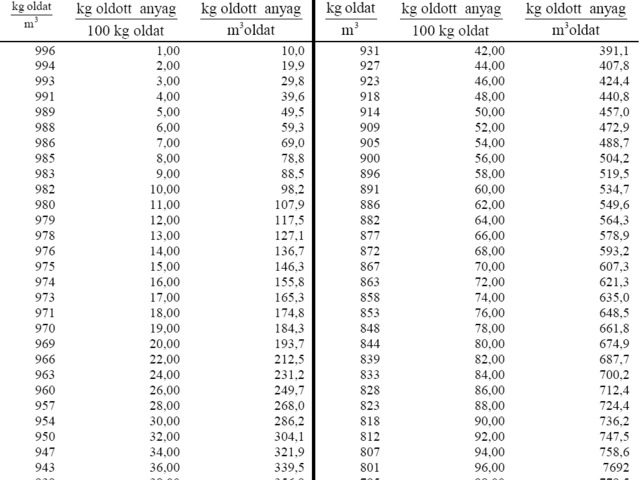
Oldatok_Középszinten
- 200g 80°C-on telített kálium-nitrát-oldatot 0°C-ra hűtünk. Mekkora tömegű só kristályosodik ki? A kálium-nitrát oldhatóság 0°C-on 13,3g/100g víz, 80°C-on 169g/100g víz.
- Számold ki a melegen és a hidegen telített oldat tömegét! Ebben tudjuk, hogy mennyi oldott anyag van ...
- Meleget lehűtjük: oldószer tömege nem változik (hiszen az oldhatóság 100g vízre van megadva), viszont hidegen kevesebb lesz az oldott anyag. Mennyivel? (oldott anyagok tömegének vagy oldat tömegének különbségével is számolhatsz)
- Az adatokat beírhatod az alábbi táblázatba:
| oldószer tömege | oldott anyag tömege | oldat tömege (1) | oldat tömege (2) | |
| 80C | 200g | |||
| 0C | (ez nem is kell) | |||
| tömegcsökkenés (kálium-nitrát kiválás miatt) |
- Az első 3 oszlop adatait az oldhatóságból számolod.
- Egyenes arányosság felírható az adatokból:
1. oldatból (......g) .......g KNO3 válik ki
2. oldatból (200g) x g
- 200g 0°C-on telített kálium-nitrát-oldatot 80°C-ra melegítünk. Mekkora tömegű só oldható még fel benne? A kálium-nitrát oldhatóság 0°C-on 13,3g/100g víz, 80°C-on 169g/100g víz.
- Az oldhatósági adatok alapján töltjük ki a táblázat első 3 oszlopát. Itt mindent be tudsz írni. (1)
| m (osz)1 | m(oa)1 | m(o)1 | m(osz)2 | m(oa)2 | m(o)2 | |
| 0C | 100 | 13,3 | 113,3 | 200g | ||
| 80C | (ez ua., mint 0C-on) | |||||
| tömeg-növekedés | - | - | (ez ua, mint az oldott anyag tömegnövekedése) |
- A második 3 adatsorból csak azt tudjuk, hogy 200 g oldatunk van. Egyenes arányosságal a 0C-hoz tartozó adatok kiszámolhatóak. (2)
- VIGYÁZAT! 80C-on az oldat tömegét nem ismerjük, csak az oldószerét!!! Ezzel számolok egyenes arányosságot! (Ismert tömegű oldószerben mennyi anyag oldódik 80C-on)
- A feladat arra kíváncsi, mennyi sót adsz a hidegen telített oldathoz! Látod az adatot?
- 100g víz 20oC-on maximálisan 5,90g KAl(SO4)2-ot old fel. Mennyi a kristályvizes só oldhatósága ezen a hőmérsékleten, maximálisan hány gramm KAl(SO4)2∙12H2O oldható fel 100g vízben 20oC-on? Ar(O) = 16; Ar(S) = 32; Ar(K) = 39, Ar(Al) = 27, Ar(H) = 1
- Számoljuk ki a vízmentes só anyagmennyiségét!
- Kristályvizes sóból ugyanekkora anyagmennyiséget kell feloldani, hogy a sót bevigyük az oldatba, DE!!! ha kristályvizes volt a só, akkor kevesebb vizet kell hozzáadnom. Számold ki, hogy az előbb kiszámolt anyagmennyiségű kristáylvizes sónak mekkora a tömege, ebből mennyi a víz.
- Tehát ennyivel kell kevesebb víz a só felodásához.
100g - ...gvízben .......g kristályvizes só oldódik
100g vízben x g
- Hány g kristályvíztartalmú szódát kell feloldani 400g 10,0tömeg% szódát tartalmazó oldatban, hogy 15,0tömeg%-os oldatot kapjunk? (1 mol nátrium-karbonát 10mol vízzel kristályosodik.)
- Keverési egyenlettel számolok:
- 1. 400g 10%
- 2. A kristályvizes szódát úgy veszem, mintha oldat lenne: kiszámolom a tömegszázalékos összetételét, így csak ennek az "oldatnak" (ami nem igazi oldat, hanem kristályvizes só) a tömegét nem ismerem.
- Kálium-klorid és nátrium-klorid keveréke 55,0 tömeg% klórt tartalmaz.
- Hány tömeg% kálisó van a keverékben?
- Hány tömeg% nátriumiont tartalmaz az az oldat, amelyet úgy készítünk, hogy 16,4g keveréket 80,0g vízben feloldunk?
- Induljunk ki 100g porkeverékből, amiben 55g Cl van. Gyűjtsük táblázatba az adatokat!
| KCl | NaCl | Cl | |
| m (grammban) | x | 100 -x | 55 |
| M | |||
| n |
- A táblázat adataiból egyismeretlenes egyenletet tudok összerakni: ebbe kell behelyettesíteni
- n(KCl) + n(NaCl) = n(Cl)
- 700,0 liter 38,0 térfogatszázalék tiszta etil-alkoholt tartalmazó barackpálinkából eladtak 100,0 litert, majd a maradékot vízzel feltöltötték 700,0 literre.
a, Mekkora térfogatú vizet adtak hozzá?
b, Az új összetételű pálinka hány térfogatszázalék etil-alkoholt tartalmaz?
A víz sűrűsége 1,00g/cm3. A többi szükséges adatokat becsülje meg (vagy számítsa ki) a táblázatban található értékek segítségével! A pálinkát tekintse etanol-oldatnak.
Etanol-oldatok sűrűsége és összetétele 20 °C-on
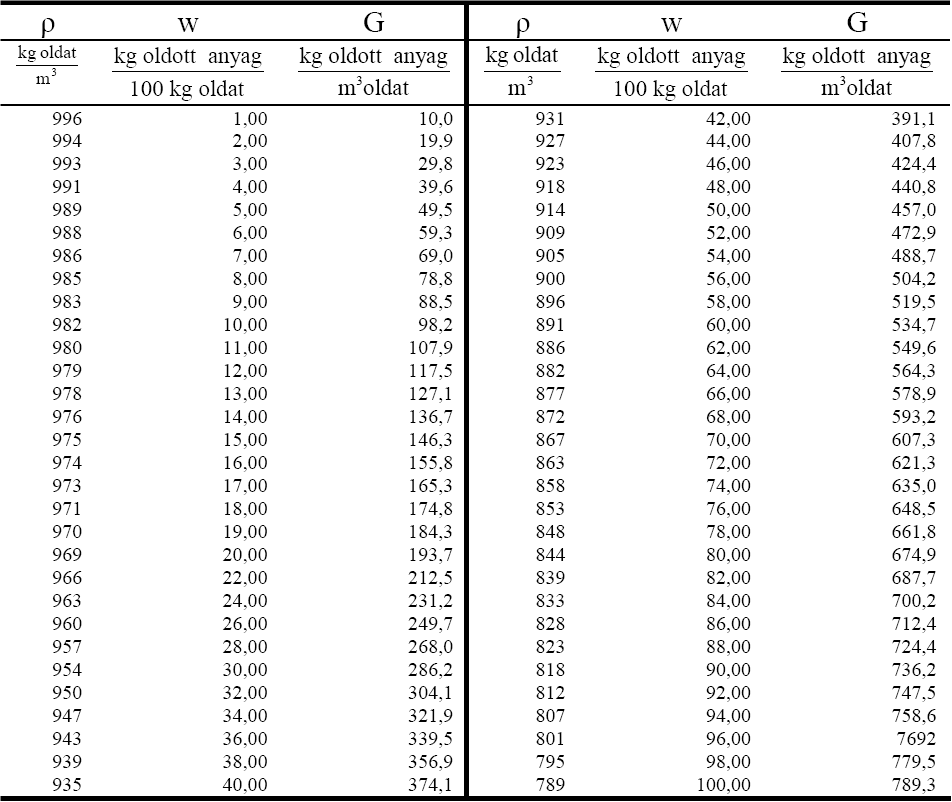
- Először a b, részt tudjuk kiszámolni:
- 600l 38%-os maradt: számoljuk ki, hogy ez hány dm3 100%-os alkoholnak fele meg
- Ez a mennyiségű tiszta alkohol (V oldott ag.) lesz benne 700l páleszben (V oldat) --> térfogat% számolható (32,6% lesz)
- Most tudjuk az a, részt számolni: A hozzáadott víz kb. 100l, de a térfogati kontrakció miatt tutira több!!! Először a hozzáadott víz tömegét kell számolni:
- Az abszolút alkohol tömegét ki tudom számolni a sűrűség segítségével (179,89g lesz). Ez az oldott anyag tömege.
- Ha tudnám az oldat tömegét, kiszámolhatnám az oldószer (víz) tömegét. Tehát: ki kell számolnom az új oldat tömegét sűrűség segítségével, DE! csak térfogat%-os összetételt ismerek, a táblázat pedig tömeg%-ot (w) és tömegkoncentrációt tartalmaz (sajnos G-vel jelöli gamma helyett). Nincs mese, át kell számolni tömegkoncentrációra. (1000dm3 oldatban hány kg oldott anyag van) (257 kg/m3 lesz) Ehhez is csak becsülni tudjuk a sűrűséget, de azt megtehetjük (958,5-nek becsültem) Na ezzel számolom ki a hígított oldat tömegét. (671,2 kg lesz)
- Még nincs kész! A HOZZÁADOTT VÍZ térfogata kell (vigyázat, először tömeget számolok!). Nadejó! Akkor kell az eredeti oldatban lévő víz tömege is. Akkor most megint:
- Eredeti oldatban (700dm3) 38% abszolút alkohol volt --> ennek a térfogata ....., sűrűséggel tömegre számolva .... (209,95kg lesz)
- Átszámolom tömegkoncentrációra .... (299,934kg)
- Sűrűséget megbecsülöm (951,4) ... Eredeti oldatból 600dm3-t hígitok, ennek tömege ... (570,8kg)
- A pirossal kiemelt számok különbsége a hozzáadott víz tömege
- Hány tömeg% vas(III)-kloridot tartalmaz az az oldat, amelynek kloridion koncentrációja 1,20mol/dm3? Az oldat sűrűsége 1,31g/cm3.
- Írd fel az elektrolitos disszciáció egyenletét! 1 mol vas-kloridból 3 mol klorid lesz, tehát a kloridkoncentráció háromszor akkora, mint a vaskloridé, vagyis .... (0,4)
- 0,4 mol vas-kloridot tömegre váltom, ez lesz 1dm3 oldatban, aminek a tömegét ki tudom számolni a sűrűséggel. Így már tömeg% számolható.
- Egy ammónium-szulfátot és ammónium-nitrátot tartalmazó kevert-műtrágya 28,0tömeg% nitrogént tartalmaz.
a, Mennyi a keverék tömeg%-os összetétele?
100g porkeverékből indulunk ki, amiben 28g N van. Táblázatba gyűjtjük az adatokat!
| ammónium-szulfát | ammónium-nitrát | nitrogén | |
| M (ezt kiszámolod) | |||
| m (grammban) | x | 100-x | 28 |
| n (só) | - | ||
| n(N): a sóban lévő N anyagmennyisége | - | ||
| m (N): a sóban lévő N tömege (nitrogén moláris tömegének ismeretében) | 28 |
- n(N): a sóban lévő N anyagmennyiség: 1 mol ammónium-szulfátban 2 mol N van, tehát a N anyagmennyisége kétszerese a só anyagmennyiségének.....
- Egyismeretlenes egyenletet kapok, ha ebbe behelyettesítek:
- m (N) -ek összege = 28
- x=50,72g (ez volt az ammónium-szulfát tömege)
b, A keverékből 300g-ot oldunk 1liter vízben. Az ekkor keletkező oldat sűrűsége 1,15g/cm3. Ajánlható-e ez az oldat növények öntözésére tápoldatként, ha a növényi tápoldatok ideális N tatalma: 20-30g nitrogén/liter oldat között van. Válaszát számítással indokolja!
- oldat tömeget számolok (1l/1000g víz+300g por), ebből térfogatot
- a por 28%-a N, vagyis .... (84g), ez van az előbb számolt térfogatú oldatban.
- Mostmár tömegkoncntrációt számolhatok, amit összevetek a megadott adattal
c, Hány tömegszázalékos NH3-oldatot kaphatunk úgy, hogy a keverékből 50g-ot szilárd NaOH-dal hevítünk, és a keletkező gázt teljes egészében 100cm3 desztillált vízbe vezetjük?
50g porban mennyi az egyes sók tömege, anyagmnnyisége, ezek alapján mennyi bennük az ammónia anyagmennyisége, ennek mennyi a tömege? (ezek mehetnek táblázatba). Na ezt oldjuk 100 g vízben. A többit nem mondom meg.
- A laboratóriumban rendelkezésünkre áll 10,0 tömegszázalékos ammóniaoldat, amelynek sűrűsége 0,960g/cm3. Réztárgyak szennyezett felületének megtisztítására 30,0 tömegszázalékos ammóniaoldatra volna szükségünk. 100cm3 10,0 tömegszázalékos ammóniaoldatban mekkora térfogatú 25oC-os, standard nyomású ammóniagázt oldjunk, hogy a kapott oldat 30,0 tömegszázalékos legyen?
Ne ússzunk el az információtengerben! Ez egy töményítési feladat, keverési egyenlettel oldjuk meg! 10%-os oldatban (aminek tömegét ki kell számolni) tiszta ammóniát (100%) nyeletünk el, és 30%-os oldatot kaounk. Képben vagytok?