Általános kémia 2.: Kémiai kötések és kölcsönhatások
6. lecke: Kémiai kötések
Olvasd el: 7. osztály - kémiai kötések
- Miért alakítanak ki kötéseket az atomok? Mire törekednek?
- Hogyan csoportosítjuk a kötéseket?
- Definíciók: ionkötés, fémes kötés, kovalens kötés
- Mit mutat meg az EN? Hogyan változik a periódusos rendszerben? Hogyan határozza meg az EN az elsődleges kötést?
- Milyen kötés lehet az elemekben és a vegyületekben?
- Kálcium és magnézium vízzel való reakciójában melyik elem a reakcióképesebb? Miért? Milyen kísérlttel bizonyítottuk?
- Tk. 37/5: Milyen kötést alakítanak ki egymással a nátrium atomjai, a szén atomjai és a klór atomjai?
- Tk. 37/6: Milyen kémiai kötés jön létre az alábbi elemek atomjai között:
a) nátrium és fluor, b) magnézium és oxigén, c) hidrogén és oxigén? Írd le a vegyületek képleteit is!
7. lecke: Ionkötés, ionrácsok
Olvasd el: 7. osztály - Ionok
- Mit nevezünk ionnak? Hogyan csoportosítjuk az ionokat?
- Jellemzd az egyszerű kationt, aniont!
- Hogyan alakul ki az ionkétés? Mutasd be a NaCl példáján!
- Hogyan változik az atomok és az ionok mérete a periódusos rendszerben?
- Hogy viszonylik az anion ill. a kation mérete az atomhoz?
- Mi jellemző az ionrácsos kristályokra?
- Rácsenergia, ionizációs energia, elektronaffinitás fogalma
- Hogyan keletkeznek az összetett anionok és kationok? Mutass be párat!
Tk. 41/1,2,3,4
Kaptál egy feladatlapot, itt ellenőrizheted!
Dolgozat Redmentában!
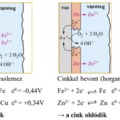
8. lecke: Fémek és fémrácsos kristályok
Olvasd el: 7. osztály - Fémek (amúgy ezt már átnézettem veeled)
- Hogyan alakul ki a fémes kötés? Mitől függ a fémes kötés erőssége?
- Jellemezd a fémrácsos anyagokat!
- Hasonlítsd össze a vezetők (fémek) és a félvezetők (félfémek) áramvezetásánek hőmérsékletfüggését!
- Milyen kristályszerkezete lehet a fémeknek? Nevezz meg 3 félét, majd nézd meg jellemzőiket a SNFT-ban!
- Mit nevezünk könnyű és nehézfémeknek?
- 3 tetszőleges szempont szerint hasonlítsd össze az s, p, d és f mező fémeit!
Segítségként ez a ppt tartalmazza a válaszokat!
Emeltre készülőknek: Tk. 44/4,5
9. Kovalens kötés molekulákban és atomrácsokban
Olvsd el: 7. osztály - Elemmolekulák
7. osztály - Vegyületmolekulák
Kovalens kötés fogalma
Rajzold le szerkezeti képlettel és összegképlettel, hogyan képződik atomokból molekula a hidrogén, a klór, az oxigén és a nitrogén esetén! Jelöld a kötő és a nemkötő elektronpárokat!
Jellemezd a kötéseket! (Segít a fénymásolat fogalomgyűjteménye)
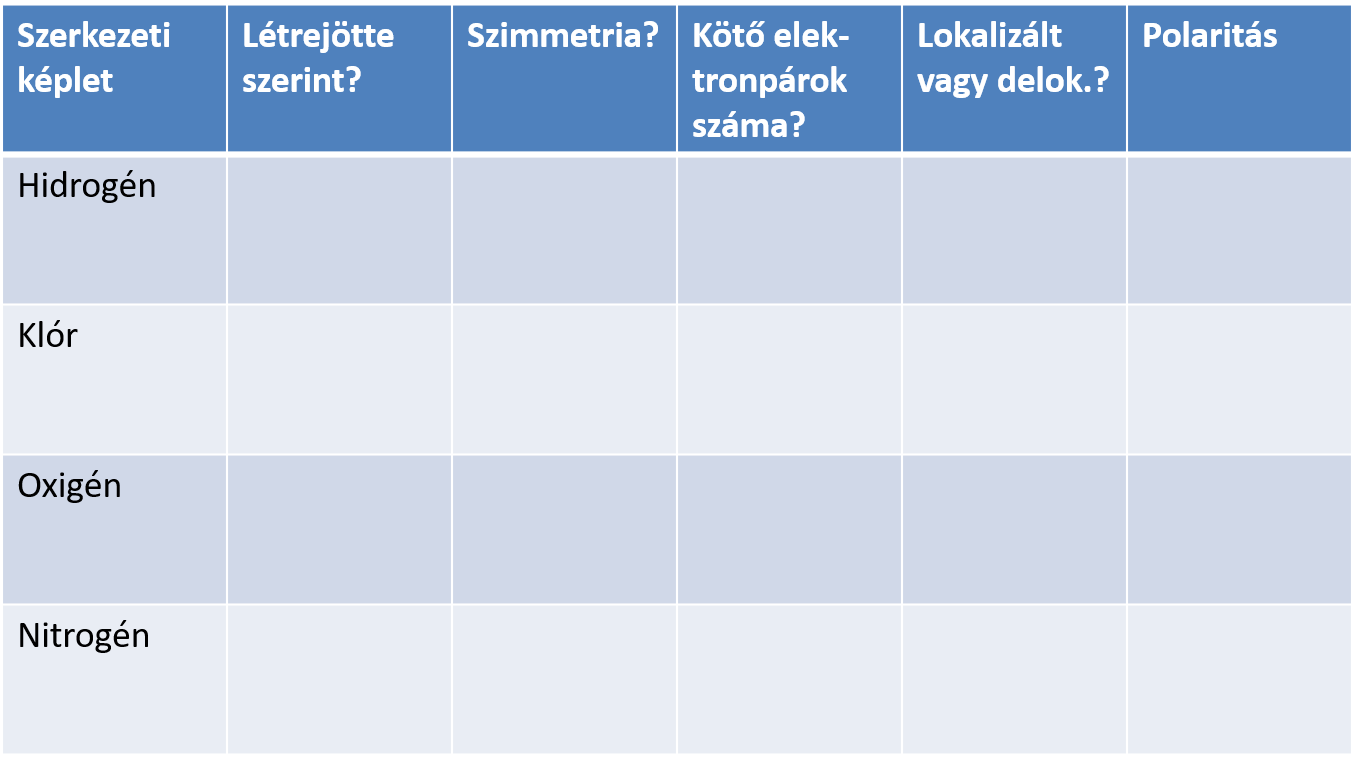
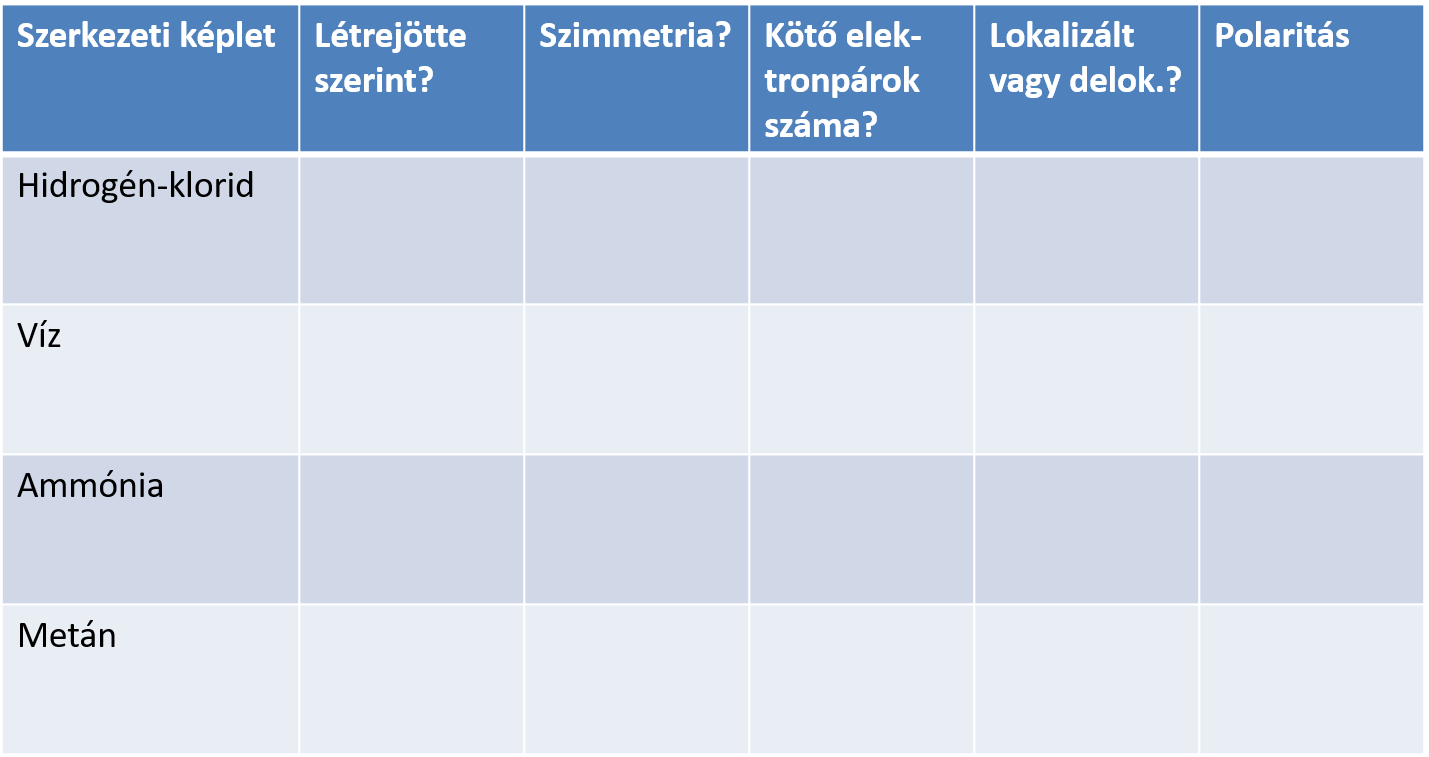
Rajzold be a táblázatba a vegyületmolekulák szerkezeti képletét, majd töltsd ki a táblázatot!
Atomrácsos kristályok jellemzői: a gyémánt és a grafit rácsának összehasonlítása: Olvassátok a szénmódosulatokról szóló tankönyvi bejegyzést! Készíts összehasonlító táblázatot!
Próbáld meg, hogy megy-e! Válogasd szét a tulajdonságokat! Learning Apps
Hf. Tk. 49/1, 3,4,8,9
10. Molekulák alakja és polaritása
I. Molekulák alakja
Ezen a feladatlapon dolgozunk majd!
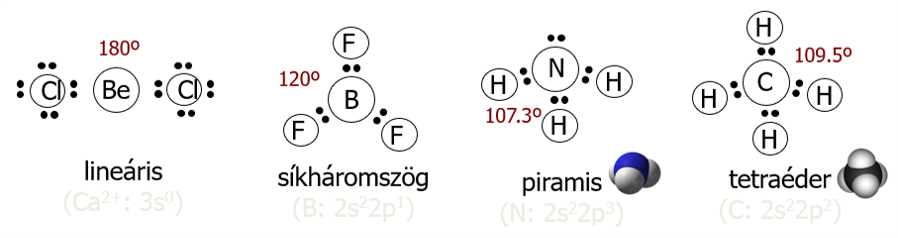
3D szerkezet: a központi atom nemkötő elektronpárjainak és a s kötő elektronpárok kölcsönhatása határozza meg. Cél:
- a kötő és nemkötő elekronpárok egymástól legtávolabb helyezkedjenek el
- a rendelkezésre álló legnagyobb teret foglalják el
- nemkötő elektronpár térigénye nagyobb (NH3 piramis míg CH4 tetraéder)
- AXE képlet
II. Polaritás
- Apoláris kötés esetén a molekula is apoláris.
- Poláros kötéssel kapcsolódó kétatomos molekulák polárisak.
- Poláris kötéssel kapcsolódó többatomos molekulák polaritása függ a szimmetriától:
- Apoláris a molekula, ha a polaritásvektorok összege 0
- Poláris a molekula, ha a polaritásvektorok összege nem 0

11. Molekulák közti kapcsolatok
Molekularácsok jellemzői