01. Kovalens kötés
Ismétlés: Ismételd át, mit tanultál 7. osztályban a kovalens kötésről és a molekulákról!
Új anyag:
Négyjegyű függvénytáblázatot érdemes alaposan megismerni ebben a témában! 282-294. o.
Kaptál egy feladatsort nyomtatva. Szeretnék segítséget kapni a megoldásához!
Nézd meg ezt is: a 6. feladatban segíteni fog!
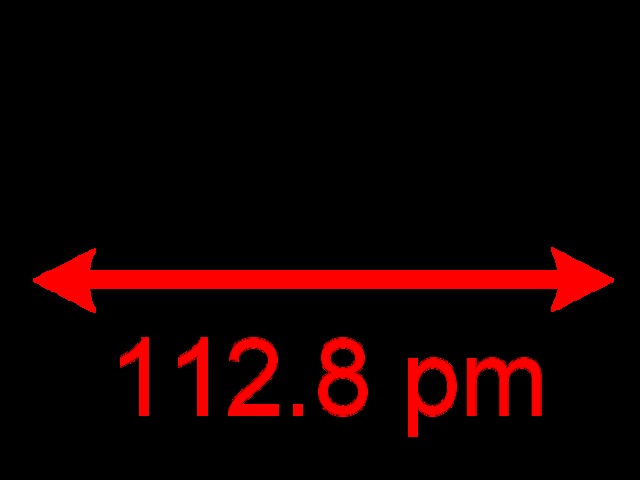
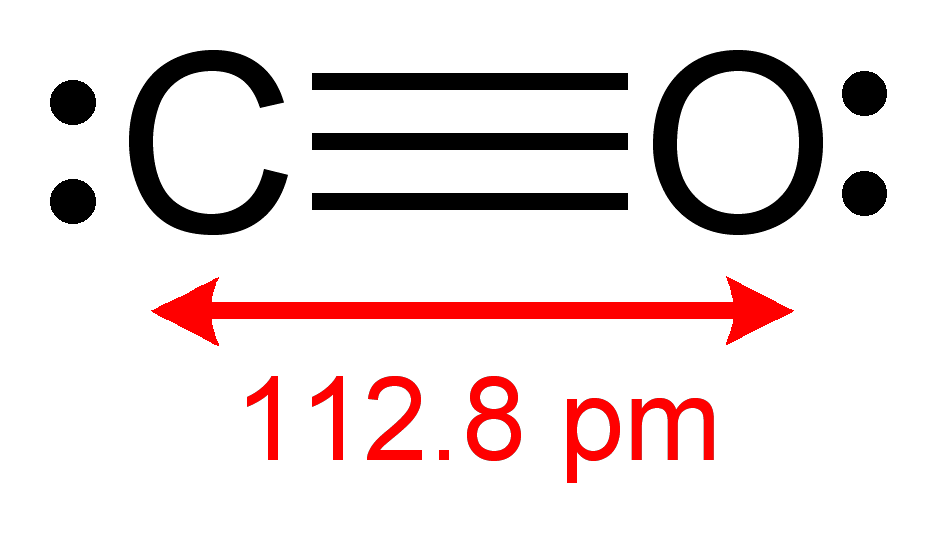
Szén-monoxid: Ez egy kivételes molekula, mert datív kötést tartalmaz: az oxigén egyik nemkötő elektronpárját bedobja a közösbe (vagyis az egyik kötést létesítő elektronpár MINDKÉT ELEKTRONJA az oxigénből jön), így nem marad meg a szokásos két nem kötő elektronpár az oxigénen, ahogy nem lesz meg a szénnek sem a szokásos 4 vegyértéke
Szén-dioxid: Külső elektronok számának ismeretében megállapítható. De ha nem jöttél rá, akkor íme: (érdemes általános képletbe átírni, molekulaalakot meghatározni. Ne feledd: X ligandumot jelent, tehát itt az oxigént, E pedig nemkötő elektronpár a központi atomon, ami itt a szén, és azon nincsen!)
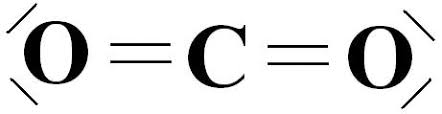
Hidrogén-cianid: Ennek ki lehet logikázni a szerkezetét a külső elektronok számának ismeretében. Ha nem jöttél rá, akkor dádám:

Miért nem jó egyedül?
Egy kis QUIZZZ ...
Kémiai kötések QUIZLET tanulókártyák itt, de most játszani fogunk velük! Erre gyere!
Egy kis vidi ...
Molekulák alakja
Ha már kezded érteni, akkor használd a következő szimulációkat!
Molekulaalakok - alapok: beállítható a molekulageometria is, és a kötésszög.
- Először nézd meg a valódi molekulákat (lent: valódi molekulák fül)!
- A fenti feladat molekuláit rajzold le a füzetedbe, rakd össze a modelljét (molekula alakok fül)!
- Hasonló az előzőhöz, de mutatja a nemkötő elektronpárokat is, így segíti annak értelmezését, miért is oly nagy ennek a térigénye.
- Letöltés után 2-3 atomos moleklák polaritása és elektromos térben való viselkedése modellezhető