Elektrolízis
Próbáld ki a szimulációt: Elektrolízis szimuláció
Elektrolizáló cella

- Hogyan állítjuk össze?
- Melyik ion semlegesítődik?
Ha többféle elektródreakció lehetséges, akkor
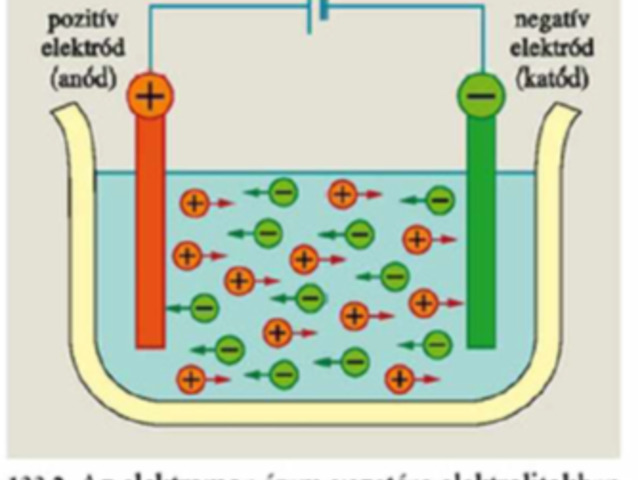
ANÓDON: (pozitív pólus)
- halogenidion (klorid, bromid, jodid) fog leválni,
- ennek hiányában vízbontás történik (oxigéngáz fejlődik)
KATÓDON (negatív pólus)
- fémkiválás (fémion-tartalmú oldatból) általában csak akkor várható, ha az adott fém standardpotenciálja pozitív.
- A hidrogéngáz fejlődése némelyik elektródon gátolt (túlfeszültség), emiatt bizonyos negatív standardpotenciálú fémek (pl. a cink) is leválaszthatók.
- Alkálifémek, alkáliföldfémek vizes oldatból csak speciális elektródon választhatók le (pl. a nátrium higanyelektródon).
- Ha nincs fémion, vagy nem választható le, akkor a víz redukálódik (hidrogéngáz keletkezik).
A fenti szabályok alapján meg kell tudni állapítani:
- elektrolitban milyen ionok vannak
- melyik pólus felé vándorolnak
- melyik vesz részt az elektródfolyamatban
- hogy változik az oldat kémhatása
- hogy változik az oldat koncentrációja
- hogy változik az elektródok tömege
Összesen 9 elektrolízises kémiai folyamatot kell nagyon begyakorolni!
Kísérletek feladatlapja és megoldása
Videók:
2.Sósavoldat elektrolízise Videó
Érdekesség
Ráadásként egy érdekesség: házaló kereskedők által forgalmazott víztisztító berendezések népszerűsítése úgy történik, hogy csapvizünket elektrolizálják, bizonyítandó annak szennyezettségét:
Magyarázat:
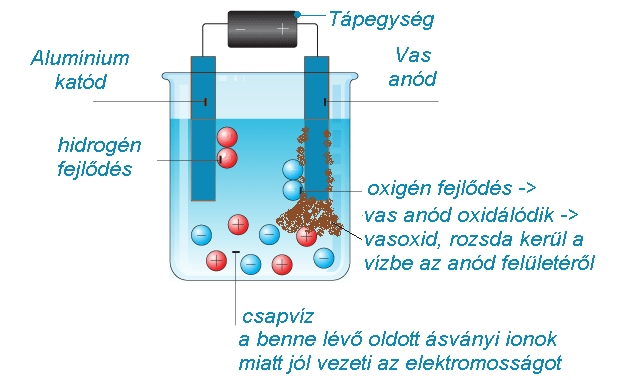
Az átveréshez használt eszköz egy elektrolizáló készülék, ami működhet elemmel, de 230V-os hálózatról is. Lényeges, hogy két kinyúló fém elektródája közül az anód vasból vagy vasötvözetből legyen, a katód lehet pl. alumínium. A folyamat, amitől megzavarosodik a víz, egy egyszerű elektrolízis. Ha az elektródákat a csapvízbe merítjük, akkor a benne lévő pozitív és negatív ionok (csapvíz esetén ásványi anyagokból származó ionok, pl. kalcium, magnézium, nátrium, fluorid, szulfát, stb. és a víz saját ionjai, hidrogén- és hidroxid-ionok) mind-mind a nekik ellentétes töltésű elektróda felé mozognak. A víz saját ionjaiból az alumínium-katódon hidrogén, a vas-anódon oxigén fejlődik. A vas-anódon fejlődő oxigén azonnal oxidálja az anód anyagát, vörösbarna vasoxid keletkezik (esetleg, ha a vasötvözet nikkelt is tartalmaz, akkor zöldes iszap válik le), ami az ionok áramlása miatt gomolyogva belekeveredik a vízbe.
Tehát a vörös zavaros anyag nem a vízből származik, hanem az anód anyagából!
A trükk még hihetőbb, amikor a csapvíz megzavarosodása után bemutatják, hogy desztillált vízbe vagy a "csoda-tisztítóval" kezelt vízbe bemerítve az elektrolizáló készüléket, nincs zavarosodás, és a "szakember" részéről mindjárt jön is az indoklás: "mert ezek a vizek tiszták"! Erre is van alapvető fizikai magyarázat: az elektrolízis egyik alapfeltétele, hogy a folyadék, amibe az elektródákat bemerítjük, vezesse az áramot. Azok a folyadékok vezetik az áramot, amelyek oldott ásványi ionokat tartalmaznak, így pl. a csapvíz, ásványvíz igen, de a desztillált víz és egyes "csoda-tisztítóval" kezelt (lágyított és deionizált) vizek nem, ezért az utóbbiak nem is elektrolizálhatók szemmel látható mértékben. (Forrás: Pannonvíz.hu)
Ami a víztisztítást illeti: IGAZ! A tisztító berendezés a fordított ozmózis elvén működik, membránján 0,0001 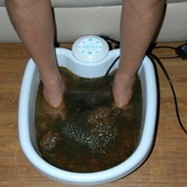 mikronig semmi nem megy át! (kiszűri a hormonokat, vírusokat, nehézfémeket, és sajnos az ásványi sókat is!). Ezért kapunk egy visszasózó patront a tisztító mellé, és tádám! Már vissza is kapjuk az ionokban gazdag vizet! Na hát a kísérletet persze nem ezzel végzik!
mikronig semmi nem megy át! (kiszűri a hormonokat, vírusokat, nehézfémeket, és sajnos az ásványi sókat is!). Ezért kapunk egy visszasózó patront a tisztító mellé, és tádám! Már vissza is kapjuk az ionokban gazdag vizet! Na hát a kísérletet persze nem ezzel végzik!
És ugyanezen elven működik a méregtelenítős lábmosó is!